转自:罗氏诊断生命科学微信公众号
什么是dPCR系统的死体积?
预反应体积与反应体积之差称为死体积(dead volume)【1】,其中预反应体积是指分区之前准备的初始体积,包括master mix、引物、探针以及待检测样本;反应体积是指被检测到的分区总体积n×Vp,n为分区总数,Vp为分区体积。
死体积一般是在分区过程中产生,如制备过程移液步骤过多、复杂管路设计、分区过程的挤压设计、分区后的稳定性等,有一些仪器的检测过程也会降低样品的利用率。
任何生物分析都存在二次抽样误差,只有部分样品被分析而不是全部,导致重复检测之间的统计差异。例如血液样本处理量可以达到几毫升,而dPCR检测体系一般只有几十微升。二次抽样是一个不可避免的误差来源,尤其是在样品中目标分子很少的情况下。由二次抽样引起的检测误差可以由以下公式(1)进行计算【2】,其中m是二次取样中目标分子的数量,对于95%的置信度,Zc应为1.96。
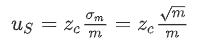
(1)
死体积的存在导致dPCR运行过程中对样品进行再次抽样,其引起检测结果的影响可参考二次抽样误差计算。A. Lievens等人也模拟了不同样品利用率和各种λ值的情况下再次抽样对结果误差的影响【3】。

图1 样本利用率与检测误差率的关系
图片来源:罗氏诊断整理
图1纵坐标表示误差超过25%的结果比例,横坐标表示用于分析的样本比例,图1的A中:蓝色表示目的基因λ=0.003,红色表示目的基因λ=0.015,黄色表示目的基因λ=0.03;图1的B中:蓝色为目的基因λ=0.001,红色为目的基因λ=0.005,黄色为目的基因λ=0.01。结果表明绝对误差超过25%的结果比例与样品利用率成负相关,既死体积越大,出现误差偏高的机率越大。
从一个简单的例子可以进一步解释死体积对dPCR检测结果,尤其是低拷贝模板的检出率的影响。
如图2【4】所示:在不存在死体积的情况下,样本拷贝数为15,分区数量为15。如死体积率为5%,有效分区数约为14~15,样品检出率在12~15拷贝之间;如死体积率为25%,有效分区在11~12,样品检出率在4-15拷贝;死体积率为50%,则有效分区数为7~8,样品检出率为2~13拷贝。死体积率越高,检测结果的稳定性越低,检出限(LOD)也随之降低,这一效应在低拷贝样品中尤其明显。

图2 dPCR分区
图片来源:Journal of Food Protection, Vol. 74, No. 9, 2011, Pages 1404–1412.
与qPCR相比,dPCR检测过程需要经过分区这个过程,死体积率的出现不可避免,但死体积率与检测结果的稳定性和检出限成负相关,尤其是在检测低拷贝样品时需要重点关注dPCR系统的死体积率,尽可能选择死体积率低的系统,以保证结果的准确性。
参考文献:
【1】Clinical Chemistry, Volume 66, Issue 8, August 2020, Pages 1012–1029 ;
【2】SLAS Technology, Volume 22, Issue 4, August 2017, Pages 369-386 ;
【3】PLoS One, Volume 11, Issue 5, May 2016 ;
【4】Journal of Food Protection, Vol. 74, No. 9, 2011, Pages 1404–1412.
* MC-CN-02328 有效期至2025年8月5日
活动最终解释权归罗氏诊断生命科学所有。

-1S.jpg)
-2S.jpg)